Страница 13 из 17
Все эти подробности уводят нас очень далеко от воззрений Демокрита на атомный мир, но основная мысль остается прежней: Вселенная состоит из определенного набора основных «кирпичиков», которые обладают уникальными внутренними свойствами и вступают в бесчисленное множество сочетаний, создавая все богатство нашей реальности. Эти «кирпичики» мы, взяв термин Платона, назвали элементами13, и теперь мы готовы исследовать все девяносто четыре их разновидности – и позволить им выступить нашими проводниками к далеким и минувшим временам.
Глава 4
Элементы: наш набор «кирпичиков»
Элемент – одно из тел, на которые разложимы другие тела, но неразделимое в самой своей сути1. Аристотель
По мере того как в XVIII столетии и в начале XIX века накапливалось все больше свидетельств существования атомов, становилось ясно, что строительные блоки некоторых веществ, в отличие от сотен изучаемых субстанций, не получалось разложить на более базовые формы. Антуан Лавуазье, уделив внимание этим несократимым субстанциям, дал своему трактату, изданному в 1789 году, название «Начальный учебник химии» и перечислил в нем тридцать три элемента. Некоторые из них, как мы уже отмечали, такие как «свет» и «теплород» (последний считался флюидом, переносившим тепло), появились в результате неверного понимания природы вещества и энергии, а другие оказались молекулами, состоящими из нескольких элементов; впрочем, двадцать три элемента были истинными и признаются такими и в наши дни.
Как мы упоминали в третьей главе, модель атома, которую предложил Нильс Бор, содержит все характеристики, необходимые нам, чтобы завербовать атомы на службу истории. Их основная структура, подобная планетарной, показана на рисунке 3.3. Здесь мы расширим базовую модель и покажем, что у атома также есть оболочки и подоболочки, а также поговорим о том, по каким законам их заполняют электроны. Так мы, в свою очередь, объясним и устройство Периодической таблицы химических элементов, и подготовим сцену для исчисления тех межатомных взаимодействий, которые и составляют всю нашу Вселенную.
К 1869 году, когда Дмитрий Менделеев опубликовал свою важную систематизацию элементов, его таблица содержала шестьдесят три субстанции и предсказывала появление еще нескольких. В то время единственными известными свойствами элементов был их относительный вес (вычисленный на основе соотношений масс, в которых они сочетались с другими элементами), а также готовность вступать в такие соотношения и проявляемая при этом избирательность. Свои предсказания о существовании новых элементов и возможности их обнаружения Менделеев основывал на закономерностях, проявленных в свойствах известных элементов, которые, в соответствии с их поведением, указывались в одинаковых столбцах, а возрастающий номер в строке отражал увеличение массы. Это распределение, создаваемое без знания размера, массы или внутренней структуры атома, не говоря уже о каком-либо понимании того, что было причиной их поведения, оказалось пророческим, и мы сохраняем его по сей день как Периодическую таблицу химических элементов (см. рис. 4.1).
Элементы в столбцах слева в высшей степени активны химически. Водород легко взрывается (прекрасный пример – катастрофа «Гинденбурга»2), а Литий (Li), Натрий (Na) и Калий (K) полыхнут пламенем, если уронить их в пробирку с водой. Они любят соединяться с элементами из предпоследнего столбца справа, которые тоже охотно вступают в химические реакции, и предпочитают формировать очень стойкие сложные соединения, например соль (NaCl). Но элементы, занявшие самый правый столбец, никакими «уговорами» не объединить ни с их соседями, ни с любым другим элементом таблицы3. Чтобы понять, почему поведение различных групп атомов столь радикально отличается, нам потребуется представить модель Нильса Бора в количественном отношении и рассмотреть квантовую природу атомного мира.
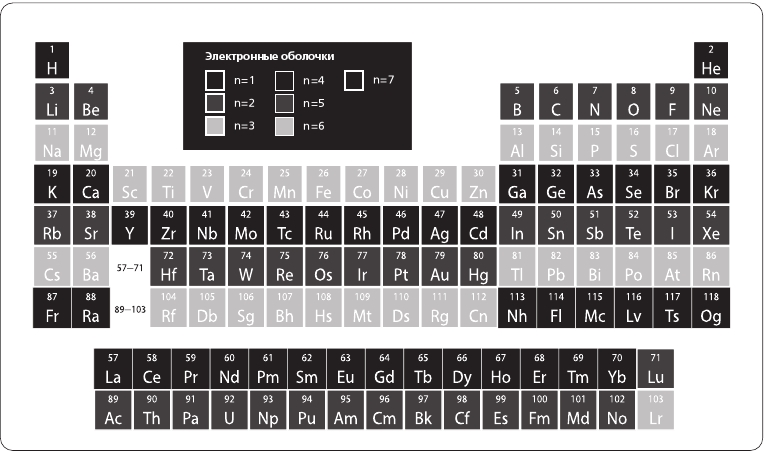
Рис. 4.1. Периодическая таблица химических элементов. Показаны атомные номера и символы для каждого из 118 типов атомов. Шкала полутонов и толщина контуров призваны проиллюстрировать природу электронных оболочек, речь о которых пойдет ниже. В самом левом столбце каждая строка обозначает начало нового энергетического уровня, но n = 3 и n = 4 частично совпадают (иными словами, за элементом под номером 18, Аргоном [Ar], имеющим три электронные оболочки [n = 3], следуют Калий [K] и Магний [Mg], у которых по четыре электронных оболочки [n = 4], после чего у элементов 21–30 вновь n = 3). Совмещения усложняются по мере того, как мы движемся все дальше, вследствие чего строки 57–71 и 89–103 располагаются в самом низу таблицы. Подробнее см. рис. 4.3 и 4.4
Как мы отмечали в третьей главе, электроны не похожи на планеты (равно как и на уменьшенные песчинки). Они действуют в квантовом мире, и это означает, что их поведение представляет собой сочетание тех свойств, которые мы приписываем частицам, а также тех свойств, которые мы приписываем волнам. И частицы, и волны могут передавать энергию (эту концепцию мы более подробно изучим в дальнейшем) из одного места в другое. Если я брошу вам бейсбольный мяч, а вы его поймаете, то вы почувствуете боль из-за кинетической энергии (энергии движения), которую я сообщил мячу, совершив бросок. По мере того как частица перемещается с места на место, она переносит с собой энергию. Точно так же ее переносит и волна, хотя в этом случае в движении какого-либо вещества от меня к вам нет необходимости. Если мы оба возьмемся за концы веревки, я могу резко дернуть свой конец вверх и вниз, и волна, прошедшая через веревку, передаст это движение вашей руке, в то время как частицы веревки, которые я держу в своей ладони, останутся на месте.
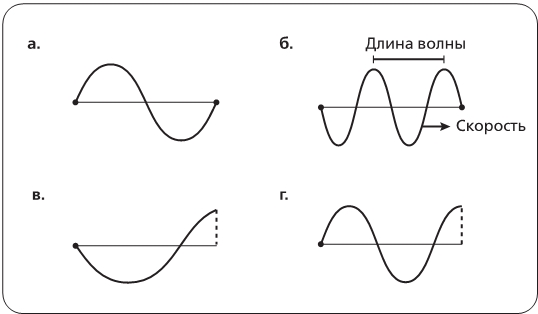
Рис. 4.2. На рис. а полная длина волны умещается между двумя закрепленными концами струны. На рис. б между ними умещаются две полных длины волны (обертон на октаву выше). Но на рис. в и г мы видим, что иные длины волн – слегка увеличенная и слегка укороченная – невозможны, поскольку нарушается условие, согласно которому концы струны должны оставаться неподвижными
Рамка 4.1. Уровни энергии Водорода
Длина волны частицы в квантовой механике определяется как h/mv, где m – это масса частицы, v – ее скорость, а h – постоянная Планка = 6,63 × 10–34 Дж·c.
Радиус орбиты электрона в атоме Водорода: r = 5,29 × 10–11 м
Масса электрона: m = 9,11 × 10–31 кг
Скорость электрона на орбите: v = 2,18 × 106 м/с (примерно 0,7 % скорости света)
Таким образом, длина волны электрона составляет:
6,63 × 10–34 Дж·c / (9,11 × 10–31 кг × 2,18 × 106 м/с) = = 3,3 × 10–10 м
Длина окружности орбиты электрона составляет 2π × 5,29 × 10–11 м, что в точности равняется длине волны электрона в квантовой механике – орбита определяется одной целочисленной волной, охватывающей ее пределы.
Кинетическая энергия электрона = 1/2 mv2 = 1/2 × 9,11 × × 10–31 кг × (2,18 × 106 м/с)2 = 2,16 × 10–18 Дж.