Страница 12 из 17
Исследование квантового мира – это увлекательная тема, которой посвящено множество книг, однако нам незачем углубляться в этот предмет. Наша цель – использовать атомы, чтобы выявить поддельные произведения искусства; выяснить, как наши предки научились выращивать кукурузу; представить, как выглядела укрытая льдом Земля 400 000 лет назад; и узнать, как появилась Солнечная система. Таким образом, все, что нам нужно, – это модель атома, которая бы точно содержала все характеристики, необходимые для наших экспертно-криминалистических обращений к истории мира. Такую модель нам еще сто с лишним лет назад предоставил датский физик Нильс Бор.
Вероятно, вы видели эту хрестоматийную картинку (см. рис. 3.3), в которой атом представлен как миниатюрная Солнечная система и вокруг ядра, расположенного в центре, вращаются, подобно планетам, электроны. Мы примем ее, но тем не менее важно помнить об ограничениях аналогии с Солнечной системой. Во-первых, в Солнечной системе тела взаимодействуют посредством гравитации, в то время как электроны удерживаются на месте электромагнитными силами. Во-вторых, протяженность орбит значительно различается, и тогда как планеты движутся по ним на расстояниях, которые от 41 до 3200 раз превышают диаметр Солнца, протяженность первой электронной орбиты в атоме Водорода превышает диаметр протона в 24 000 раз, и для атомов это соотношение размеров совершенно типично (вспомните теннисный мячик на 120-й улице и электрон на 145-й).
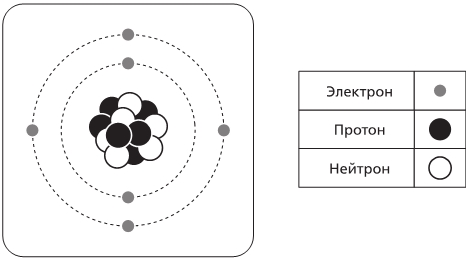
Рис. 3.3. Репрезентация боровской модели для атома Углерода, содержащая главные характеристики, необходимые нам, – протоны и нейтроны ядра и четко определенную систему электронов, движущихся вокруг ядра по орбите. Обратите внимание, что рисунок выполнен в условном масштабе; если бы размеры реального ядра совпадали с изображенными, то электроны следовало бы отобразить примерно в 300 метрах от него
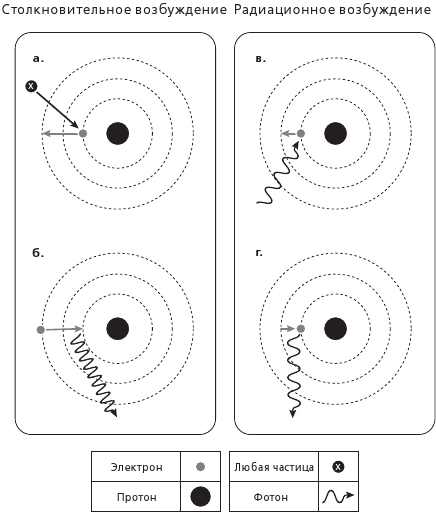
Рис. 3.4. У атома Водорода только один электрон, и этот электрон может перемещаться по орбите вокруг протона лишь на особых, точно заданных расстояниях. Они определены допустимыми длинами волн электрона (см. гл. 4) и соответствуют его конкретным энергиям (см. рис. 4.5, где приведены численные значения этих энергий). Если электрон получит необходимое количество энергии – либо благодаря столкновению с другой частицей, как в случае а, либо поглотив фотон, как в случае в, то он сможет перескочить на одну из допустимых орбит, и в этом случае его называют «возбужденным». В дальнейшем он вновь вернется в основное состояние, испустив излишек энергии в форме света (случаи б и г). Обратите внимание, что чем значительнее скачок, тем больше выделяется энергии и тем короче длина волны света (б в сравнении с г). В люминесцентных лампах атомы газа, присутствующие в трубке лампы, при помощи столкновений переводятся в возбужденное состояние, благодаря чему при возвращении электронов в основное состояние возникает свет
Атом Водорода настолько прост, насколько это возможно, – ядро, состоящее из одного протона, и один-единственный электрон на орбите. В нормальных условиях этот электрон остается на своей орбите, о границах которой мы говорили выше, но если по атому ударяет другая частица или рядом оказывается странствующая световая волна подходящего цвета, электрон может перейти на другую, более высокую орбиту, расположенную дальше от ядра. Но он не может перемещаться везде, где захочет, а ограничен лишь определенными, четко заданными расстояниями (см. рис. 3.4). В других атомах, где электронов больше, для каждого из них установлен набор особых дистанций. Такая система орбит играет очень важную роль в том, как атомы взаимодействуют друг с другом и со светом, что позволяет нам распознавать их по всей Вселенной. Об этих системах мы поговорим в следующей главе, в которой объясним устройство Периодической таблицы, ставшей украшением стен в каждом школьном классе, где изучают химию.
Молекула
Теперь мы совершим последний шаг в нашем восхождении от фундаментальных частиц к частичкам вещества, из которых состоит наш узнаваемый мир, и поговорим о молекулах. Как мы уже упоминали, молекула – это сочетание двух и более атомов, одинаковых или различных, сцепленных в особом, четко зафиксированном соотношении. Кислород, который мы вдыхаем, – это молекула Кислорода, в которой соединены два атома, О2 (подстрочный индекс обозначает число атомов данного рода в молекуле), а выдыхаемые нами углекислый газ (CO2) и водяной пар (H2O) – это сочетание трех атомов (где подстрочные «единички» для Углерода и Кислорода подразумеваются, но не указываются; см. рис. 3.5).
Молекулы могут оказаться сложными. Витамин С состоит лишь из двадцати атомов трех типов – C6H8O6, а вот витамин B12 (также известный как цианокобаламин) – уже из атомов шести типов: C63H88CoN14O14P. Самая длинная молекула вашей ДНК, как мы уже отмечали, содержит миллиарды атомов.
И хотя у атомов нет ни крючков, ни проушин, ни шарниров, которые представляли себе древние греки, распределение их внешних электронов уникально для каждого из девяноста четырех элементов, и эти электронные конфигурации управляют связями, в которые склонен вступать тот или иной атом. В следующей главе мы объясним, почему некоторые из них постоянно задействуют режим «привлечения», другим компания требуется не так сильно, а третьи вообще предпочитают пребывать в одиночестве и вполне этим довольны. Орбиты электронов, соединяясь, слегка меняют расположение, укрепляют связи, создают тем самым особое трехмерное пространство и наделяют молекулу всеми своими свойствами, которые можно ощутить извне, – например такими, как вкус, аромат, цвет, текстура и плотность, иными словами, всем тем, что отличает воду от песка, а гранат от брокколи.
Впрочем, в то время как чистая вода (H2O) и чистый песок (SiO2) состоят из одной молекулы, в гранатах и брокколи много самых разных молекул, определяющих их структуру и другие характеристики. Более того, многие вещества в нашей повседневной жизни представляют собой смешение различных атомов и молекул; например, воздух – это смесь молекул N2, O2, H2O, CO2 и множества других, не столь важных, а кроме того, в нем присутствуют атомы Аргона, Неона, Гелия, Криптона и так далее. В вашем бокале пино-нуар по большей части содержится H2O, но там есть и целое собрание других молекул, наделяющих его восхитительным ароматом.
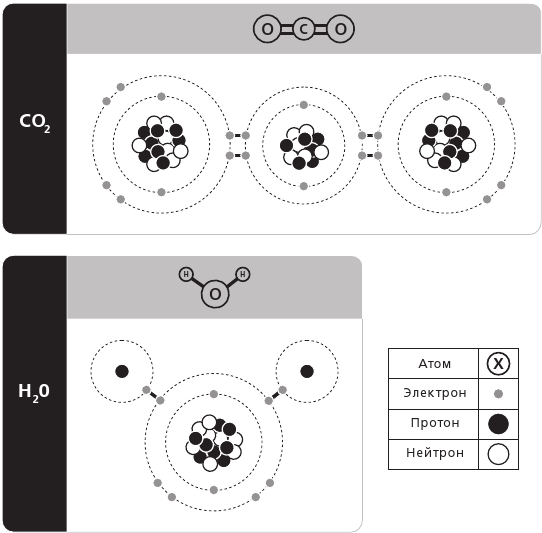
Рис. 3.5. Наглядное представление молекулы углекислого газа, на котором указано линейное распределение трех атомов и двойные связи между ними (вверху) в сравнении с изогнутой структурой молекулы воды (внизу)
Можете насладиться этим вином, поскольку наша задача завершена. Начав с грубейшей классификации мира как состоящего из твердых тел, жидкостей и газов, теперь мы знаем, что эти состояния вещества зависят от смешения частиц, которые содержатся в них, соприкасаясь друг с другом или находясь друг от друга вдалеке, а также либо могут свободно двигаться, либо прочно удерживаются на своих местах. В каждом из этих трех состояний вещество, в свою очередь, состоит из молекул, а они создаются из определенных соотношений строительных блоков, называемых атомами, которых насчитывается девяносто четыре. Атомы формируются благодаря особым сочетаниям электронов, протонов и нейтронов, а две последние частицы состоят из трех кварков каждая.