Страница 14 из 17
2,16 × 10–18 Дж × 1 эВ / 1,6 × 10–19 Дж = 13,6 эВ, это и есть энергия связи на энергетическом уровне с номером n = 1 для H.
Длина волны электрона на энергетическом уровне с номером n = 2 точно в два раза больше, и вследствие этого то же самое справедливо для длины окружности его орбиты, благодаря чему радиус можно выразить как 2r. Напряженность электрического поля ослабевает как 1/квадрат расстояния, так что 1/(2r)2 = ¼ от энергии связи на энергетическом уровне с номером n = 1; то есть 1/(2r)2 = = 13,6 эВ/4 = 3,4 эВ.
Это означает, что при переходе с n = 2 на n = 1 выделяется энергия, равная разнице в 10,2 эВ, что мы и наблюдаем.
Таким образом, при n = 3 => 13,6 эВ/9 = 1,51 эВ; при n = 4 => 13,6 эВ/16 = 0,85 эВ и так далее (см. рис. 4.5).
Любую волну описывают две количественные характеристики – расстояние между двумя смежными гребнями (длина) и стремительность, с которой волна движется вперед (скорость). Если закрепить концы струны, скажем, между нижним порожком гитары и вашим пальцем, прижимающим ее на определенном ладу гитарного грифа, в этот интервал смогут встроиться лишь определенные длины волн, соответствующие «ноте», которую вы решите сыграть (см. рис. 4.2). Если удвоить длину струны, вы получите ноту на октаву4 ниже, поскольку теперь в промежутке идеально умещается волна вдвое большей длины.
Если немного расширить эту аналогию, электроны могут существовать только при таком расположении внутри атома, при котором между ними и ядром оказывается целое число длин их волн (см. рамку 4.1, в которой делается расчет для атома Водорода). В итоге электроны могут находиться на орбитах на определенных расстояниях от атомного ядра. Вследствие этого основные оболочки обозначаются как n = 1 для оболочки, ближайшей к ядру, n = 2 для следующей по направлению от ядра, n = 3 для еще более далекой и так далее. Как мы увидим впоследствии, эти оболочки соотносятся со строками Периодической таблицы.
И все же, пусть даже принцип «одна волна – одна оболочка» совершенно справедлив и истинен, с точными конфигурациями этих охватывающих волн все оказывается чуть более затруднительным, поскольку существует второе число, которое мы в силу необходимости должны присвоить каждому электрону. Оно соотносится с формой его орбиты (его орбитальным моментом, если говорить на языке физики). Мы обозначаем это число как l, и оно принимает значения 0 (для сферической формы), 1 (три орбиты, по форме напоминающие гантели, идущие в направлениях x, y и z), а потом – 2, 3, 4 и так далее, причем по мере возрастания значений числа орбиты становятся все более сложными. Эти незначительные различия в формах орбит у той или иной оболочки называются подоболочками, или подуровнями. И, наконец, как мы отмечали в третьей главе, каждый электрон подобен маленькой юле, которая вращается либо по часовой стрелке, либо против. Этот параметр мы определили как спин: s = + ½ или s = – ½.
В квантовом мире действует абсолютное правило: хотя все электроны обладают в точности одной и той же массой и в точности одним и тем же зарядом, никакие две частицы в атоме не могут быть во всех отношениях идентичными; иными словами, ни у каких двух электронов не могут полностью совпасть значения чисел n, l и s. Более того, каждой оболочке позволено иметь лишь определенное число подоболочек: на энергетическом уровне с номером n = 1 число l = 0; при n = 2 возможны значения l = 0 и l = 1; при n = 3 число l может равняться 0, 1 и 2 и так далее. Наконец, каждая форма орбиты (определяемая значением l) может содержать 2 × (2l + 1) электронов, где первая «2» призвана указать на один электрон со спином +½ и один со спином —½, а выражение в скобках отражает число возможных орбитальных форм, доступных на каждом l-уровне. Это распределение гарантирует, что двух одинаковых электронов не существует. Все подробности прояснит схема на рис. 4.3.
Теперь, разобравшись с номенклатурой, мы можем описать конфигурацию электронов в любом атоме, указав число мест, занятых в каждой оболочке и подоболочке. Например, для Хлора, представленного на рис. 4.3, мы бы записали конфигурацию как 1s22s22p63s23p5 – в данном случае обычные числа указывают на энергетические уровни n, буквы – на обозначения числа l, а степенные показатели – на число электронов, занимающих каждую оболочку. Обратите внимание, что все подоболочки заполнены до отказа, как у любого нормального атома в спокойном состоянии, за исключением самой внешней 3p-подоболочки, на которой у нас как раз заканчиваются электроны: у Хлора 17 протонов, а значит, должно быть 17 электронов, отчего на 3p-подуровне остается пустое место. В случае, когда все электроны в атоме располагаются настолько близко к ядру, насколько это возможно, мы говорим об «основном состоянии» атома.
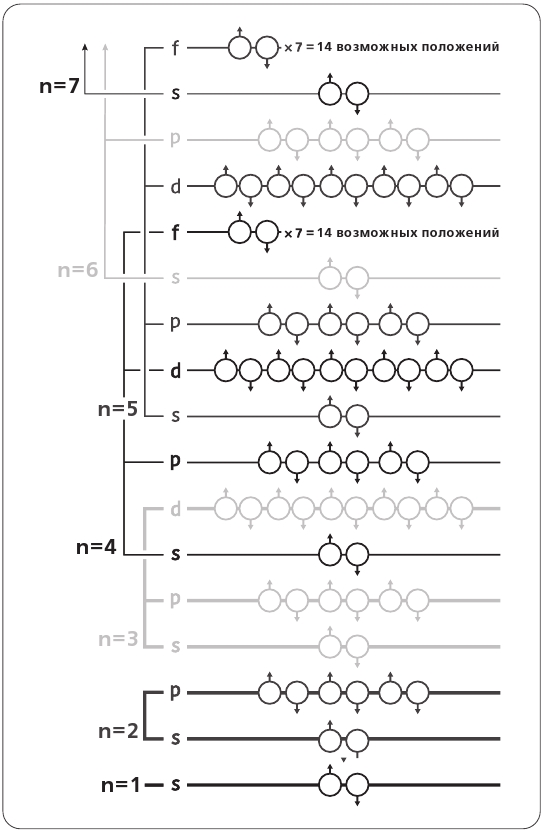
Рис. 4.3. Строение электронных оболочек у элементов Периодической таблицы. Значения n показывают энергетические уровни и соответствуют номеру строки в левой части таблицы. Заметим, что начиная с n = 3 подоболочки последующих энергетических уровней частично совпадают друг с другом. Подуровни s, p, d и f соотносятся с различными значениями числа l, призванного выразить орбитальный момент атома; этот показатель определяет форму электронных орбит (l = 0, 1, 2 и 3)
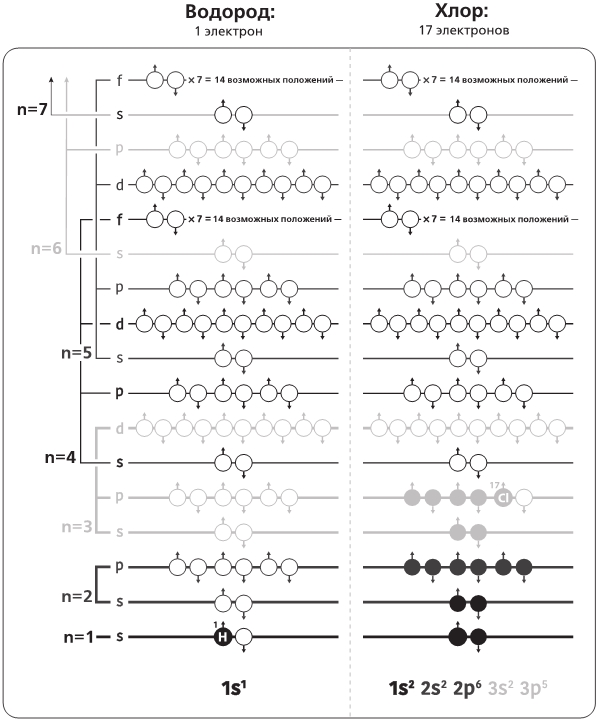
Рис. 4.3 (продолжение). Каждый подобный уровень может содержать 2 × (2l + 1) электронов. Стрелки (указывающие вверх или вниз) соответствуют допустимым спиновым квантовым числам (s = +½ или s = —½). Ни у каких двух электронов не могут совпасть все три квантовых числа n, l и s; круги показывают возможные расположения, которые согласуются с данным правилом. У Водорода, изображенного слева, всего лишь один электрон, занимающий положение 1s1. У Хлора, с семнадцатью электронами (правый столбец), заполнены два свободных места на 1s-подуровне; два – на 2s-подуровне, шесть – на 2p-подуровне; два – на 3s-подуровне и пять свободных мест из шести на 3p-подуровне. Шкала полутонов, которая в данном случае выстроена в соответствии со значениями главного квантового числа n, нумерующего энергетические уровни, совпадает со шкалой полутонов в Периодической таблице (рис. 4.1)
Здесь содержится ключ к сродству того или иного элемента с другими или к отсутствию такого сродства: атомы любят заполнять свои оболочки. Хлор в этом почти преуспел: еще один электрон, и все будет в полном порядке. Даже если ему удастся обзавестись хотя бы одним электроном, переняв его от какого-нибудь иного атома, все будет лучше, чем эта зияющая брешь на 3p-подуровне. Он мог бы заимствовать одинокий электрон у Водорода и преобразиться в сильную соляную кислоту, HCl; мог бы захватить почти столь же одинокий электрон с самой внешней оболочки Натрия, занявшего третью строку Периодической таблицы, и образовать соединение NaCl, известное нам под названием поваренной соли; или мог бы даже вступить в реакцию с Калием из четвертой строки, и создать хлорид калия, KCl – заменитель соли для тех, кто находится на строгой бессолевой диете.